1. Sinh tổng hợp naringin trong thực vật
Naringin là một glycoside flavonoid, có tên khoa học là 4’,5,7-trihydroxyflavonone-7-rhamnoglucoside, đã được phát hiện, mô tả cấu trúc phân tử vào năm 1928, được phân lập từ trái cây họ cam, quýt và là nguồn gốc tạo ra vị đắng của chúng. Khối lượng phân tử của naringin là 580,5 g/mol với công thức phân tử là C17H23O11 (hình 1) [1].
    |
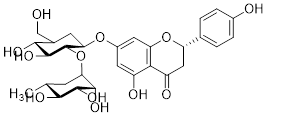 |
| Hình 1: Cấu trúc phân tử của naringin |
Naringin được sinh tổng hợp thông qua con đường phenylpropanoid. Con đường phenylpropanoid bắt đầu bằng phenylalanine-sản phẩm cuối cùng của con đường shikimate. Con đường phenylpropanoid tạo ra sự đa dạng của các hợp chất là flavonoid, tannin và lignin [2]. Nhờ 7 bước xúc tác enzyme trong quá trình sinh tổng hợp phenylproponoid tạo thành naringin (Hình 2). Bước đầu tiên là xúc tác quá trình chuyển hóa phenylalanine thành cinnamic acid nhờ enzyme phenylalanine amoniac-lyase (PAL). Phenylalanine được khử amin thành cinnamic acid và amoniac. Ở giai đoạn thứ hai, cinnamate 4-hydroxylase (C4H) xúc tác cho quá trình chuyển hóa cinnamic acid thành p-coumarate. Sau đó, p-coumarate được chuyển hóa thành p-coumaroyl CoA thông qua enzyme 4-coumarate CoA-ligase (4CL) [3]. Con đường tổng hợp p-coumaroyl CoA là con đường tổng hợp phenylpropanoid. Sau đó là quá trình đa dạng hóa thành isoflavonoid, stilben, proanthocyanidin, flavonol và anthocyanin [4]. Các enzyme chalcone synthase (CHS) và chalcone isomerase (CHI) xúc tác quá trình phân chia phenylpropanoids thành các hợp chất flavonoid. Hơn nữa, xúc tác qua trung gian uridine diphosphoglucoseflavanone 7-O-glucotransferase (UF7GT) giúp đa dạng hóa các nhóm chất chuyển hóa như flavones, flavonols, isoflavones… [4].
    |
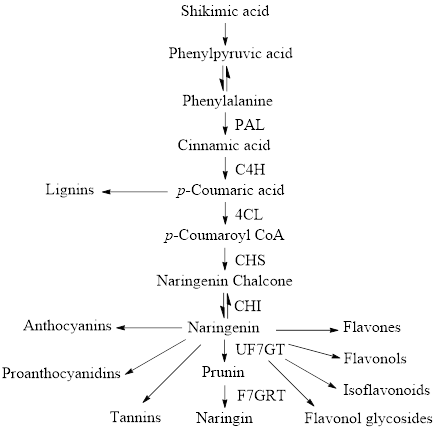 |
| Hình 2: Mô tả ngắn gọn con đường sinh tổng hợp phenylproponoid [5] |
2. Nguồn cung cấp naringin
Naringin chủ yếu được tìm thấy trong trái cây họ cam quýt như bưởi, chanh… thể hiện một số chức năng sinh học, thường được sử dụng trong thực phẩm, mỹ phẩm và y học. Hàm lượng naringin trong trái cây thường được xác định bởi độ chín của quả. Quả non có hàm lượng naringin cao hơn. Do đó, độ chín của quả là yếu tố cần được cân nhắc trong quá trình chế biến nước ép, đặc biệt là nước ép bưởi, loại nước có độ đắng cao [6]. Nhiều nghiên cứu đã chỉ ra rằng, phần cùi chứa hàm lượng naringin cao hơn trong quả bưởi, tiếp theo là phần vỏ có màng, hạt và nước ép [7]. Hàm lượng naringin trong nước ép bưởi là 220 µg/mL và trong vỏ là 3910 µg/mL. Hàm lượng naringin trong chanh rất thấp so với trong bưởi. Lượng naringin được tìm thấy trong vỏ, nước ép và hạt lần lượt là 517,2 µg/mL, 98 µg/mL và 29,2 µg/mL [8]. Hàm lượng naringin trong cam chua là 47,1 µg/mL. Ở hoa cam chua, lượng naringin ở bầu, bầu nhụy và nhụy lần lượt là 1,3444 µg/mL, 9,036 µg/mL và 2,554 µg/mL [9]. Vị đắng do naringin mang lại trong sản xuất nước ép bưởi thương mại có thể được loại bỏ bằng cách sử dụng enzyme naringinase [10].
3. Một số hoạt tính sinh học của naringin
Từ xa xưa, trái cây họ cam quýt đã được sử dụng làm phương pháp điều trị bằng thảo dược tự nhiên trong y học cổ truyền. Vỏ cam quýt đã được sử dụng trong y học cổ truyền, được gọi là trần bì, để tăng cường tiêu hóa, giảm thiểu khí dạ dày, đầy hơi và làm thông tắc nghẽn [11]. Nghiên cứu lâm sàng và dịch tễ học cho thấy ăn trái cây họ cam quýt làm giảm nguy cơ mắc các rối loạn liên quan đến lối sống như ung thư, bệnh tim mạch, tiểu đường type 2 và loãng xương [12]. Naringin đã được chứng minh là có tác dụng chống ung thư, ức chế tiểu đường type 2, kháng viêm, kháng oxi hóa,… [13]. Naringin cũng được cho là có tác dụng tăng cường hấp thu và chuyển hóa thuốc [14]. Tác dụng dược lý của nó đã được xác nhận rõ ràng thông qua các nghiên cứu trên động vật in vitro và in vivo. Ba hoạt tính sinh học nổi bật của naringin là hoạt tính chống ung thư, ức chế tiểu đường type 2 và hoạt tính chống viêm được giới thiệu dưới thiệu dưới đây.
3.1. Hoạt tính chống ung thư
Naringin đã được báo cáo là có tác dụng ức chế nhiều khối u ác tính thông qua việc điều chỉnh các tầng tín hiệu tế bào khác nhau, bao gồm ức chế sự phát triển của tế bào ác tính, gây ra sự chết tế bào, cũng như dừng chu kỳ tế bào, điều hòa stress oxy hóa, quá trình viêm và hình thành mạch [15]. Một nghiên cứu khác đã chỉ ra rằng naringin ở nồng độ từ 250-2000 M thúc đẩy quá trình chết của tế bào trong tế bào ung thư cổ tử cung (SiHa) theo cách phụ thuộc vào liều lượng. Tác động này của naringin được cho là đã góp phần ngăn chặn sự phát triển của tế bào [16]. Naringin ở nồng độ 1 M, 5 M và 10 M đã làm giảm tỷ lệ tử vong tế bào do rotenone gây ra trong tế bào u nguyên bào thần kinh ở người (SH-SY5Y) [17]. Naringin ức chế sự phát triển của tế bào ung thư bạch cầu tủy ở người dòng K562, HL-60 và Kasumi-1 theo cách phụ thuộc vào nồng độ và thời gian. Trong các tế bào ung thư bạch cầu ở người U937 và THP-1, naringin làm tăng sự chết tế bào và giảm sự tăng sinh của tế bào [18]. Các khối u não nguy hiểm và phổ biến nhất là u thần kinh đệm, gây tử vong mặc dù bệnh nhân đã được chăm sóc điều trị bằng những biện pháp tiến bộ. Do đó, cần có nhiều kỹ thuật trị liệu khác nhau để chống lại căn bệnh chết người này. Trong các tế bào u nguyên bào thần kinh đệm, naringin có thể chặn FAKp-Try397 và hạn chế hoạt động của kinase bám dính khu trú (FAK). Trong trường hợp tế bào u thần kinh đệm U251, điều trị bằng naringin đã hạn chế sự tăng sinh và khả năng tồn tại của tế bào ung thư này [19]. Đối với dòng tế bào ung thư vú MCF-7, việc điều trị bằng naringin làm giảm sự tăng sinh và tăng trưởng, đồng thời làm tăng quá trình tự hủy [20].
3.2. Hoạt tính ức chế tiểu đường type 2
Tiểu đường type 2 là bệnh rối loạn chuyển hóa carbohydrate, có đặc điểm tăng glucose máu do khiếm khuyết về tiết insulin, hoặc do đề kháng insulin hoặc cả hai. Một số enzyme liên quan đến quá trình chuyển hóa carbohydrate có thể bị ức chế bởi naringin. Naringin có khả năng ức chế glucosidase, một loại enzyme chuyển hóa carbohydrates phức tạp thành đường đơn giản, do đó, có thể làm giảm lượng glucose sau bữa ăn bằng cách ngăn chặn enzyme này, điều này sẽ làm chậm quá trình tiêu hóa và hấp thu carbohydrate. Naringin hạn chế sự bài tiết và độ nhạy cảm của insulin, chất vận chuyển glucose, lipid máu, sản xuất glucose ở gan, hấp thu glucose ngoại biên, hấp thu glucose ở ruột, sinh tổng hợp cholesterol, stress oxy hóa và viêm [21]. Ở chuột mắc bệnh thận do tiểu đường, naringin làm giảm thiểu rối loạn chức năng và tổn thương thận do streptozotocin gây ra, ức chế stress oxi hóa do streptozotocin gây ra trong cơ thể, đồng thời, ngăn ngừa sự chế tế bào và nồng độ ROS do glucose cao gây ra [22]. Trong một nghiên cứu khác, naringin cho thấy có khả năng chống viêm và chống oxy hóa ở chuột mắc bệnh thận do tiểu đường, điều hòa làm giảm cytokine viêm (interleukin 1), các cytokine tiền viêm TNF và IL-6, đồng thời điều chỉnh tăng các chất chống oxi hóa như enzyme superoxide Dismotase (SOD), glutathione (GSH) và catalase (CAT) [23].
3.3. Hoạt tính chống viêm
Viêm là phản ứng bảo vệ bình thường của cơ thể trước các tổn thương do các tác nhân gây bệnh. Viêm xảy ra khi các tế bào của bạch cầu trong cơ thể tăng cường hoạt động để bảo vệ cơ thể chống lại các nhân gây bệnh. Quá trình chống viêm được kiểm soát bởi nhân erythroid 2, là yếu tố liên quan đến hồng cầu 2 (Nrf2), điều chỉnh quá trình tổng hợp chất chống oxy hóa của tế bào và do đó đóng vai trò rất quan trọng trong việc ngăn ngừa các bệnh thoái hóa khác nhau [24]. Thực vật giàu flavanone, chẳng hạn như naringin, hesperidin và neohesperidin, từ lâu đã được biết là có hoạt tính chống viêm [25]. Nghiên cứu được thực hiện trên chuột bị viêm gây ra bởi acid 3-nitropropionic, naringin điều chỉnh tăng sự biểu hiện của mRNA trong heme oxygenase (HO-1), glutathione-S transferase P1 (GST P1), NAD(P)H:quinone oxyoreductase 1 và gama-glutamylcysteine ligase; sau đó kích hoạt Nrf2 và giảm biểu hiện của các chất trung gian gây viêm như TNF-a, cycloxygenase-2 và NO synthase [26]. Trong mô hình động vật bị viêm, naringin cũng đã được chứng minh là làm giảm việc sản xuất các yếu tố truyền tín hiệu gây viêm như interleukin-8 (IL-8), interleukin-6 (IL-6), nitric oxit synthase cảm ứng (iNOS)… Naringin, neohesperidin, paeoniflorin và platycodin-D đều được tìm thấy trong thuốc giảm đau, một loại thuốc truyền thống của Trung Quốc. Sự kết hợp bốn thành phần có tác dụng chống viêm mạnh đối với viêm cấp tính, trong khi naringin được chứng minh là có vai trò quan trọng nhất trong số bốn hoạt chất này [27].
Mặc dù naringin có tiềm năng trở thành một chất chống ung thư, ức chế tiểu đường type 2 và chống viêm hiệu quả nhưng nó không nên được sử dụng như một phương pháp điều trị độc lập. Cùng với các phương pháp điều trị khác, naringin có thể được coi một liệu pháp bổ sung hỗ trợ điều trị trong một số loại bệnh.
Tài liệu tham khảo
[1] Tripoli E, Guardia ML, Giammanco S, Majo DD, Giammanco M., (2007). Citrus flavonoids: Molecular structure, biological activity and nutritional properties: A review. Food Chem; 104:466-79.
[2] Guleria P, Kumar V., (2017). Understanding the phenylpropanoid pathway for agronomical and nutritional improvement of mungbean. J Hortic Sci Biotechnol; 92:335-48.
[3] Wang C, Zhi S, Liu C, Xu F, Zhao A, Wang X, et al., (2016). Characterization and functional analysis of 4-coumarate:coa ligase genes in mulberry. PLoS One; 11:e0155814.
[4] Winkel-Shirley B., (2001). Flavonoid Biosynthesis. A Colorful Model for Genetics, Biochemistry, Cell Biology, and Biotechnology. Plant Physiol; 126:485-93.
[5] Sharma P., Kumar V. and Guleria P., (2019). Naringin: Biosynthesis and Pharmaceutical Applications. Indian J Pharm Sci; 81(6):988-999.
[6] Zeng, X.; Su, W.; Zheng, Y.; He, Y.; He, Y.; Rao, H.; Peng, W.; Yao, H., (2019). Pharmacokinetics, tissue distribution, metabolism, and excretion of naringin in aged rats. Front. Pharmacol., 10, 34.
[7] Liu, Y.; Heying, E.; Tanumihardjo, S.A., (2012). History, global distribution, and nutritional importance of citrus fruits. Compr. Rev. Food Sci. Food Saf., 11, 530–545.
[8] Sir, K.A.; Randa, E.; Amro, A.B., (2018). Content of phenolic compounds and vitamin C and antioxidant activity in wasted parts of Sudanese citrus fruits. Food Sci. Nutr., 6, 1214–1219.
[9] Hassan, R.A.; Hozayen, W.G.; Abo Sree, H.T.; Al-Muzafar, H.M.; Amin, K.A.; Ahmed, O.M., (2021). Naringin and hesperidin counteract diclofenac-induced hepatotoxicity in male Wistar rats via their antioxidant, anti-inflammatory, and antiapoptotic activities. Oxidative Med. Cell. Longev., 9990091.
[10] Ho PC, Saville DJ, Wanwimolruk S., (2001). Inhibition of human CYP3A4 activity by grapefruit flavonoids, furanocoumarins and related compounds. J Pharm Sci; 4:217-27.
[11] Bacanli, M.; Ba¸saran, A.A.; Ba¸saran, N., (2018). The major flavonoid of grapefruit: Naringin. In Polyphenols: Prevention and Treatment of Human Disease; Academic Press: Cambridge, MA, USA; pp. 37–44.
[12] El Kantar, S.; Rajha, H.N.; Boussetta, N.; Vorobiev, E.; Maroun, R.G.; Louka, N., (2019). Green extraction of polyphenols from grapefruit peels using high voltage electrical discharges, deep eutectic solvents and aqueous glycerol. Food Chem., 295, 165-171.
[13] Bharti, S.; Rani, N.; Krishnamurthy, B.; Arya, D.S., (2014). Preclinical evidence for the pharmacological actions of naringin: A review. Planta Med., 80, 437–451.
[14] Ma, G.; Zhang, L.; Sugiura, M.; Kato, M., (2020). Citrus and Health. The Genus Citrus; Elsevier: Amsterdam, The Netherlands.
[15] Yan, Y.; Zhou, H.; Wu, C.; Feng, X.; Han, C.; Chen, H.; Liu, Y.; Li, Y., (2021). Ultrasound-assisted aqueous two-phase extraction of synephrine, naringin, and neohesperidin from Citrus aurantium L. fruitlets. Prep. Biochem. Biotechnol., 51, 780- 791.
[16] Sharma, K.; Mahato, N.; Lee, Y.R., (2019). Extraction, characterization and biological activity of citrus flavonoids. Rev. Chem. Eng., 35, 265–284.
[17] Gupta, A.K.; Dhua, S.; Sahu, P.P.; Abate, G.; Mishra, P.; Mastinu, A., (2021). Variation in phytochemical, antioxidant and volatile composition of pomelo fruit (Citrus grandis (L.) osbeck) during seasonal growth and development. Plants, 10, 1941.
[18] Li, H.; Yang, B.; Huang, J.; Xiang, T.; Yin, X.; Wan, J.; Luo, F.; Zhang, L.; Li, H.; Ren, G., (2013). Naringin inhibits growth potential of human triple-negative breast cancer cells by targeting β-catenin signaling pathway. Toxicol. Lett., 220, 219–228.
[19] Chen, R.; Qi, Q.L.; Wang, M.T.; Li, Q.Y., 2016). Therapeutic potential of naringin: An overview. Pharm. Biol., 54, 3203–3210.
[20] Aroui, S.; Fetoui, H.; Kenani, A., (2020). Natural dietary compound naringin inhibits glioblastoma cancer neoangiogenesis. BMC Pharmacol. Toxicol., 21, 46.
[21] Pandey, V.K.; Shams, R.; Singh, R.; Dar, A.H.; Pandiselvam, R.; Rusu, A.V.; Trif, M., (2022). A comprehensive review on clove (Caryophyllus aromaticus L.) essential oil and its significance in the formulation of edible coatings for potential food applications. Front. Nutr., 9, 987674.
[22]. Bharti, S.; Rani, N.; Krishnamurthy, B.; Arya, D.S., (2014). Preclinical evidence for the pharmacological actions of naringin: A review. Planta Med., 80, 437–451.
[23] Hollman, P.C.H.; Arts, I.C.W., (2000). Flavonols, flavones and flavanols-Nature, occurrence and dietary burden. J. Sci. Food Agric., 80, 1081–1093.
[24] Kumar, R.; Clermont, G.; Vodovotz, Y.; Chow, C.C., (2004). The dynamics of acute inflammation. J. Theor. Biol., 230, 145–155.
[25] Su, W.; Wang, Y.; Li, P.; Wu, H.; Zeng, X.; Shi, R.; Zheng, Y.; Li, P.; Peng, W., (2020). The potential application of the traditional Chinese herb Exocarpium Citri grandis in the prevention and treatment of COVID-19. Tradit. Med. Res., 5, 160–166.
[26] Lawrence, T.; Gilroy, D.W., (2007). Chronic inflammation: A failure of resolution. Int. J. Exp. Pathol., 88, 85–94.
[27] Shirani, K.; Yousefsani, B.S.; Shirani, M.; Karimi, G., (2020). Protective effects of naringin against drugs and chemical toxins induced hepatotoxicity: A review. Phytother. Res., 34, 1734–1744.